エントロピー増大
前回は,
と定義される微小量
を積分することでエントロピーと呼ばれる状態量
が作り出せるという話だった.不完全微分であった
が,その熱がやり取りされる時の温度
で割るだけで完全微分になるという不思議なことになっている.
を一周積分すると必ず 0 または負になるという結果を得たが,
を途中まで積分したときに増えるのか減るのかについてはまだ決め付けてはいけない.エントロピーはどういう時に大きくなって,どういう時に小さくなるのかを調べてみよう.
工夫次第で,ここまで得た知識だけからエントロピーの振る舞いを知ることができる.例えば下の図のように状態から状態
まで進み,状態
から状態
まで戻ってくることを考える.ただし,行きは準静的過程とは限らないとしよう.帰りは準静的過程で帰ってくることにする.
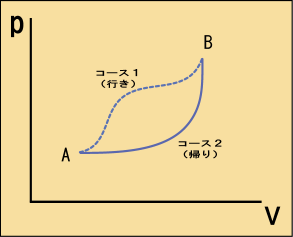
準静的過程でない場合には状態が定義できないので,グラフ上には表せない.行きのコースはそういう場合もありうるということで点線で描いてある.この行き帰りのコース全体について次のような式が成り立っている.
状態
と状態
でのエントロピーは,どこか適当なところを基準にして準静的過程で結ぶことで定義できるので,帰りコースの積分については出発点と到着点だけで表すことができて,次のように計算できる.
状態
と状態
の差が微小であるときには,
と書けるであろう.
行きのコースが準静的過程である場合には等号が成り立っている.つまり外部から熱をもらうときには右辺は正になりエントロピーは増えるし,熱を外部に与える時には右辺は負になりエントロピーは減少することが言える.
しかし不可逆過程の場合には不等号が成り立つので,それ以上にエントロピーが増える場合があるようだ.
もし行きのコースで外界との熱のやり取りがなければであるから,
が言えることになる.これが有名な「エントロピー増大則」と呼ばれるものである.つまり,断熱系で不可逆過程が起こるとエントロピーは増大することが言えるのである.
逆に「断熱系でエントロピーが増大する時は不可逆過程である」と言い換えて,熱力学の第 2 法則の代わりに使ってもいいのではないだろうか.
「断熱系ではエントロピーが増大するように現象が起こる」
これが数式の助けを借りた熱力学の第 2 法則の別表現だ.
なぜ増大するのか
何か変じゃないか?不可逆過程を含む場合にぐるりと一周積分すると負になってしまうような量が,なぜ不可逆過程を含んだ部分区間で必ず増えてしまうという結論になるのだろう?一周して負になるのは,その問題の区間で変化が負になるからではないのだろうか?感覚と逆のことが起きているような気がする.
これは,エントロピーという量が状態量であって,結局は,平衡状態でしか定義できない量であることがその理由である.不可逆過程が起きている最中のエントロピーというのは考えられない.つまり,だ…….
状態から出発して,断熱系で不可逆過程が起こり,訳が分からない状態を抜けて,気が付くと状態
にいた.しかし断熱だから
であって,たとえその時の温度
がはっきり定義できない状態であったにせよ,積分への寄与はしていないはずだ.ところがここから状態
に戻るまでの積分は負になるという.つまり,気付かないうちに高エントロピー状態へジャンプしていたのだ.とまぁ,先ほどの計算を言葉で表せばこんな具合だろう.
準静的過程なら常にだという感覚があるなら捨てなくてはならない.0 になるのは一周した時にだけ言える話だ.準静的過程でも熱の出入りがあればエントロピーは上がりもすれば,下がりもする.
行きのコースは断熱であっても,そこで不可逆過程が起こっている限り,もはや帰りは断熱では元の場所には戻って来れないということだ.これですっきり理解できただろう.
本当はもっと単純だ
ここまで,自然の状態ではエントロピーが増大する傾向があることを,主に数式に頼ることで示してきた.しかしその数式表現に感服してしまって,本質を見失ってしまうようでは困る.
エントロピーが増大するのは大した理由ではないということを説明しておこう.断熱容器の中で不可逆過程が起こるとき,一体何が起こっているのだろうか.
断熱容器の中の気体が熱い部分と冷たい部分に分かれているとする.当然,熱は熱い部分から冷たい部分へと移動する.不可逆過程の代表的な例だ.
この時のエントロピーの変化を考えよう.今までは高熱源が容器の外にあって,そこから気体が熱を受け取る時にが正であるとしてきたが,今回のケースでは自らの内にある高温の部分から熱が逃げるのだから負で表されるべきである.一方,その熱を容器の中の低温部が受け取ることになるが,これは正として表すべきだろう.温度を変化させないくらいのわずかな熱
が移動したとすると,この時の全体のエントロピー変化は次のように表せる.
この式の 2 つの項を比較すれば,第 2 項目の方が分母が小さい分だけ強い.当然,全体としてプラスになる.
エントロピーが増加するのは,単にこれだけの理由である.
自然はエントロピーを増大させようとしてある方向に動くのではない.そんな神秘的なことは決して起こっていない.また,自然界のエントロピーが増大しなければならないことが数学的に証明されたのでもない.一方に進むような現象を観察していて,これを「エントロピーが増大する」という言葉で言い表しておけば扱いやすいだろうから使ってやろう,というだけのことだ.
思い出すといい.もともとカルノーサイクルを考察していて導かれただけの式ではないか.考察の途中で,「カルノーサイクルは第 2 法則を満たすから」という理由を差し挟んだが,その根拠は経験や観察によるものでしかない.
エントロピーが増大する真の理由は統計力学に説明してもらうことを期待しよう.
カルノーサイクルが簡単に
準静的過程の断熱変化ではエントロピーは変化しないことが分かった.それでこれを「等エントロピー変化」と呼ぶことがある.
ところで,カルノーサイクルは等温変化と断熱変化で囲まれていた.以前はカルノーサイクルをグラフ上で表したが,
と
で状態図を描けば,カルノーサイクルはその上に非常にシンプルに表せるのではないだろうか.見てもらうのが一番早い.
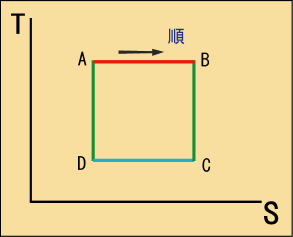
真四角だ.ここでを横軸に持ってきたのは意味がある.以前
グラフでサイクルを描いた時に,
であることから,その作る面積が全仕事量を表しているのだという結論を得た.今回も似たような話ができる.一番上で掲げた式をよく見ると,
という,前とよく似た関係になっているではないか.つまり
で積分すると熱量を表すことになるのだ.
から
への積分は高熱源から受け取った熱を表し,
から
への積分は負になるが,これは低熱源へ捨てた熱を表す.その差は何かと言えば,当然,仕事に変わった熱である.
面白い!結局,グラフでの面積と同じものを表しているわけだ.カルノーサイクルに限らず,このことは言える.
修正履歴
(2004/11/22)
工事中の表示を解除.
(2023/11/26)
読みやすくなるようにわずかに修正.積分計算がAB間の差で書き換えられることなど.「全微分」と書いていた部分を不完全微分と対比しやすいように「完全微分」と変更.










